AG Prof. Mohrmann: Neurophysiologie und zelluläre Bildgebung
Forschung
Chemische Signale sind für die neuronale Kommunikation im Nervensystem essentiell. So werden bei der synaptischen Transmission lokal Neurotransmitter-Moleküle aus kleinen synaptischen Vesikeln ausgeschüttet, die zugehörige postsynaptische Rezeptoren aktivieren und dort elektrische Signale erzeugen, welche wiederum im postsynaptischen Neuron verrechnet werden. Unsere Arbeitsgruppe ist besonders daran interessiert, wie auf molekularer Ebene bei der Exozytose eine Verschmelzung von Vesikeln mit der präsynaptischen Membran zustande kommt. In unseren bisherigen Studien haben wir deshalb Struktur-Funktionsanalysen an sogenannten SNARE-Proteinen („soluble NSF receptor“-Proteinen) durchgeführt. Dazu haben wir die funktionellen Eigenschaften von mutierten SNARE-Proteinen mit Hilfe von elektrophysiologischen (Membrankapazitätsmessungen und Amperometrie) und biochemischen Methoden charakterisiert. Bei diesen Arbeiten haben wir uns insbesondere auf das SNARE-Protein SNAP-25 konzentriert, das zusammen mit zwei weiteren SNARE-Bindungspartnern den zentralen Fusionskomplex zwischen den Membranen bildet. Unsere Untersuchungen zeigten dabei eindrucksvoll, dass der spezielle strukturelle Aufbau von SNAP-25, bei dem zwei SNARE-Motive über eine flexible Linker-Domäne miteinander verknüpft sind, für einen schnellen und effizienten Ablauf der Membranfusion absolut erforderlich ist (Shaaban et al., 2019).
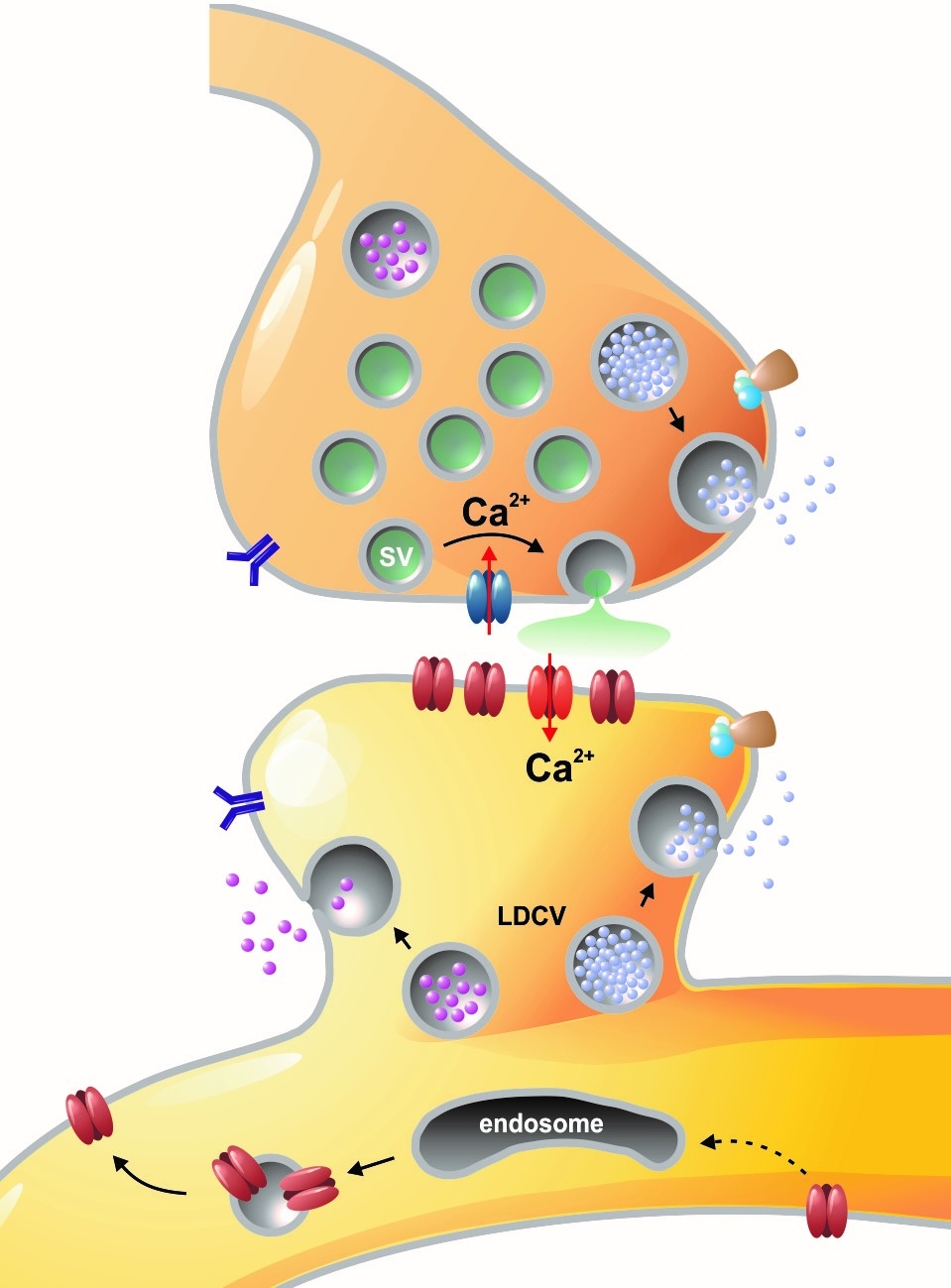
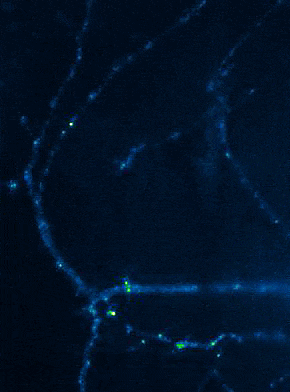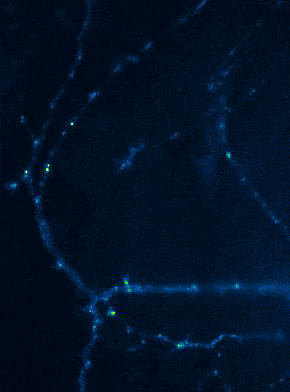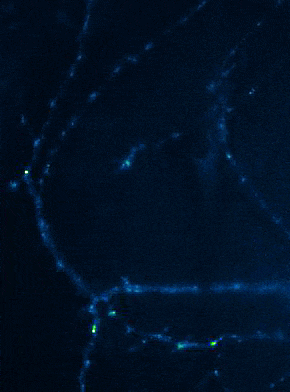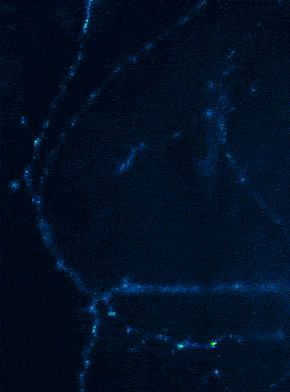
Links: Übersicht über Membranfusionsvorgänge im Bereich von Synapsen. Rechts: AMPA-Rezeptorinsertionsereignisse (SEP-GluR1) in Dendriten.
Membranfusionsvorgänge sind in Neuronen nicht nur auf präsynaptische Boutons beschränkt, sondern finden bei allen „Trafficking“-Prozessen zwischen Zellkompartimenten und Plasmamembran statt. Aus Sicht der neuronalen Informationsverarbeitung ist es besonders interessant, die Transportprozesse, über die die postsynaptischen Transmitter-Rezeptoren die dendritische Oberfläche und die Synapsen erreichen, genauer zu analysieren. Tatsächlich unterliegen Neurotransmitter-Rezeptoren an Synapsen bzw. auf Dendriten einem ständigen Zyklus aus Internalisierung und erneuter Exozytose, wobei die Reinsertion von Rezeptoren dann gewöhnlich aus dendritischen Recycling-Endosomen erfolgt. Aktivitätsabhängige Veränderungen der Insertionsrate von Neurotransmitterrezeptoren liegen putativ auch den plastischen Veränderungen der Stärke glutamaterger Synapsen zugrunde, wodurch vermutlich die synaptische Rekrutierung von AMPA-Rezeptoren gesteigert wird. Die spezifischen Signale, die determinieren, ob ein gegebener AMPA-Rezeptor einem schnellen Re-Insertionszyklus unterworfen ist, liegen allerdings noch im Dunkeln. Mit Hilfe fluoreszenzmarkierter AMPA-Rezeptoren untersuchen wir deshalb in aktuellen Versuchsvorhaben, wie sich die Anwesenheit verschiedener auxiliärer Untereinheiten in AMPA-Rezeptorkomplexen auf das dendritische Trafficking auswirkt. In einer bereits abgeschlossenen Studie konnten wir mit Hilfe von „Live Cell“-Imaging-Versuchen bereits nachweisen, dass die modulatorisch-wirkenden Untereinheiten Tarpg-8 und CKAMP44, die beide nicht an der Bildung der Kanalpore beteiligt sind, starken Einfluss auf die Kinetik des dendritischen „Turnovers“ von AMPA-Rezeptoren nehmen. In der Tat scheint die Anwesenheit dieser auxiliären Untereinheiten in AMPA-Rezeptorkomplexen den Internalisations-Exozytose-Zyklus zu verzögern und die Rezeptoren auf der Oberfläche zu stabilisieren (Harb et al., 2021). Eine Identifizierung der „Trafficking“-Signale in beiden auxiliären Untereinheitentypen steht allerdings noch aus.
Methoden:
- „Live-Cell“-Imaging fluoreszenzmarkierter Proteine und Ca2+-Imaging, Konfokalmikroskopie, 2P-Mikroskopie, Immunohistochemie
- Elektrophysiologie: Whole-Cell Patch-Clamp-Messungen evozierter und spontaner postsynaptischer Ströme, Membrankapazitätsmessungen und Amperometrie
- Molekularbiologie und virale Expressionssysteme
- Biochemie: Proteinexpression, Western Blots und Pull-down-Experimente






